Reaksi substitusi adalah bentuk reksi kimia, di mana suatu atom dalam senyawa kimia digantikan dengan atom lainnya. Reaksi substitusi adalah salah satu reaksi yang penting dalam kimia organik.
Reaksi substitusi dalam kimia organik dikelompokkan sebagai elektrofilik atau nukleofilik bergantung pada reagen yang digunakan, apakah suatu zat antara yang reaktif terlibat dalam reaksi tersebut adalah suatu karbokation, suatu karbanion atau suatu radikal bebas atau apakah substratnya merupakan suatu alifatik atau aromatik. Pemahaman mendetail mengenai jenis reaksi mampu membantu untuk memprediksi produk yang dihasilkan dari reaksi tersebut. Pemahaman ini juga berguna untuk mengoptimasi suatu reaksi dengan mempetimbangkan variabel seperti suhu dan pemilihan pelarut.
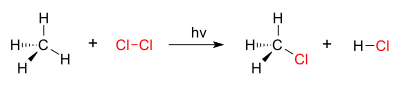
Contoh dari reaksi substitusi adalah halogenasi. Ketika gas klorin (Cl-Cl) di iradiasi, sejumlah molekul terpisah menjadi dua radikal klor (Cl.) yang elektron bebasnya merupakan nukleofil kuat. Satu atom H dalam metana (CH4) mampu digantikan dengan 1 atom Cl dalam gas klorin (Cl2) menjadi metil klorida (CH3Cl) dan asam klorida (HCl).
Substitusi nukleofilik
Dalam kimia organik (dan anorganik), substitusi nukleofilik adalah reaksi fundamental di mana suatu nukleofil secara selektif berikatan dengan atau menyerang muatan positif atau parsial positif pada suatu atom atau kelompok atom. Saat hal tersebut terjadi, nukleofil akan menggantikan nukleofil yang lebih lemah yang kemudian akan menjadi gugus pergi; sisa atom yang bermuatan positif atau parsial positif menjadi suatu elektrofil. Entitas molekuler keseluruhan di mana elektrofil dan gugus pergi berpisah biasanya disebut sebagai substrat.
Bentuk umum dari reaksi ini dituliskan sebagai:
- Nuc: + R-LG → R-Nuc + LG:
Pasangan elektron (:) dari nukleofil (Nuc:) menyerang substrat (R-LG) sehingga membentuk ikatan kovalen yang baru yaitu Nuc-R-LG. Keadaan bermuatan sebelumnya kembali seperti semula ketika gugus pergi (LG) lepas dengan suatu pasangan elektron. Produk dasar pada reaksi tersebut adalah R-Nuc. Dalam reaksi semacam ini, nukleofil biasanya bermuatan netral atau negatif, sementara substrat biasanya bermuatan netral atau positif.
Contoh dari substitusi nukleofilik adalah pada hidrolisis suatu alkil bromida, R-Br, dalam kondisi basa, dimana nukleofil penyerang adalah basa OH− dan gugus perginya adalah Br−.
- R-Br + OH− → R-OH + Br−
Reaksi substitusi nukleofilik merupakan reaksi yang umum dalam kimia organik, dan dapat secara luas dikelompokkan berdasarkan tempat berlangsungnya reaksi pada karbon dari suatu senyawa karbon alifatik jenuh atau (agak sering) pada suatu aromatic atau pusat karbon tak jenuh lainnya.
Mekanisme
Substitusi tersebut dapat dihasilkan dari mekanisme berbeda yang dikelompokkan sebagai: substitusi nukleofilik unimolekuler (SN1) dan substitusi nukleofilik bimolekuler (SN2).
Mekanisme SN1 memiliki dua tahapan reaksi. Pada tahap pertama, gugus pergi terlepas, membentuk suatu karbokation C+. Dalam tahapan kedua, reagen nukleofilik (Nuc:) menempel pada karbokation dan membentuk suatu ikatan kovalen sigma. Jika substrat memiliki karbon kiral, mekanisme ini dapat menghasilkan baik berupa inversi stereokimia atau retensi konfigurasi. Biasanya keduanya dihasilkan tanpa arahan. Produk utamanya adalah rasemat.
Sebagai contoh mekanisme reaksi ini adalah pada reaksi tert-butil bromida dengan air (lihat pada reaksi SN1).
| Mekanisme SN1 pada karbon kiral |
|---|
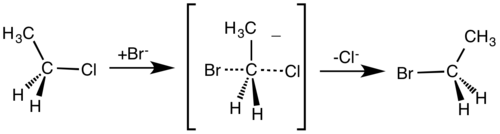
Mekanisme SN2 hanya memiliki satu tahapan reaksi. Penyerangan reagen dan pelepasan gugus pergi terjadi secara bersamaan. Mekanisme ini selalu menghasilkan inversi konfigurasi.
Jika substrat yang merupakan target penyerangan nukleofil bersifat kiral, reaksi akan mengarah pada inversi stereokimia yang disebut sebagai inversi Walden.
Sebagai contoh mekanisme reaksi ini adalah pada reaksi kloroetana dengan ion bromida (lihat pada reaksi SN2).
| Mekanisme SN2 |
|---|
Penyerangan pada SN2 dapat terjadi jika rute sisi belakang penyerangan tidak terdapat halangan sterik oleh substituen atau substrat. Karenanya, mekanisme ini biasanya terjadi pada suatu pusat karbon primer yang tak terhalang. Jika terdapat halangan sterik pada substrat dekat gugus pergi, seperti pada pusat karbon tersier, substitusi yang terjadi lebih disukai mengikuti mekanisme SN1 dibandingkan SN2, (SN1 dapat pula disukai bila zat antara karbokation yang stabil dapat terbentuk).
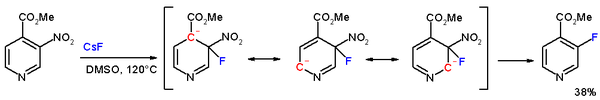
Jika substrat adalah suatu senyawa aromatik jenis reaksi yang terjadi adalah subtitusi nukleofilik aromatik. Turunan asam karboksilat bereaksi dengan nukleofil dalam subtitusi nukleofilik alkil. Jenis reaksi tersebut dapat berguna dalam preparasi senyawa.
| Substitusi nukleofilik aromatik pada pridina |
|---|
| Substitusi nukleofilik asil |
Substitusi elektrofilik
subtitusi elektrofilik adalah reaksi fundamental di mana melibatkan suatu elektrofil, khususnya dalam subtitusi elektrofilik aromatik.
Dalam contoh berikut struktur resonansi elektron pada cincin benzena diserang oleh suatu elektrofil E+. Ikatan resonansi rusak dan suatu struktur karbokation beresonansi terbentuk. Akhirnya suatu proton terlepas dan suatu senyawa aromatik baru terbentuk.

Reaksi elektrofilik pada senyawa tak jenuh lainnya selain arena secara umum mengarah pada adisi elektrofilik daripada substitusi.

Substitusi radikal
Suatu reaksi substitusi radikal melibatkan radikal bebas. Sebagai contoh adalah pada reaksi Hunsdiecker.

Substitusi organologam
Reaksi penggandengan adalah suatu jenis reaksi yang dikatalisis oleh logam yang melibatkan suatu senyawa organologam RM dan suatu halida organik R'X yang bersama-sama bereaksi membetuk suatu senyawa dengan rumus kimia R-R' dengan pembentukan suatu ikatan kerbon-karbon yang baru. Contoh reaksi ini adalah reaksi suzuki.
Senyawa tersubstitusi
Senyawa tersubsitusi adalah senyawa kimia di mana satu atau lebih atom hidrogen pada struktur intinya telah digantikan dengan suatu gugus fungsional seperti alkil, hidroksi, atau halogen, atau dengan gugus subtituen yang lebih besar.
Sebagai contoh, benzena adalah suatu cincin aromatik sederhana. Benzena yang telah tersubsitusi merupakan suatu kelompok senyawa kimia heterogen dengan sifat dan kegunaan yang luas:
| Contoh senyawa benzena tersubstitusi | ||
| Senyawa | Rumus kimia | Struktur |
| Benzena | C6H6 | 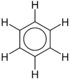 |
| Toluena | C6H5-CH3 | |
| o-Xilena | C6H4(-CH3)2 | 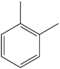 |
| Mesitilena | C6H3(-CH3)3 |  |
| Fenol | C6H5-OH | 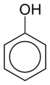 |
Reaksi eliminasi adalah salah satu jenis reaksi organik di mana dua subtituen dipisahkan dari suatu molekul baik dalam mekanisme satu atau dua-tahap. Mekanisme satu-tahap dikenal sebagai reaksi E2, dan mekanisme dua-tahap dikenal sebagai reaksi E1. Angka pada nama reaksi tidak berhubungan dengan jumlah tahapan dalam mekanisme tersebut, namun berkaitan dengan kinetika reaksi, bimolekular dan unimolekular berturut-turut. Dalam kasus yang jarang terjadi, untuk molekul yang memiliki gugus pergi yang buruk, jenis reaksi ketiga, E1CB, terjadi.
Mekanisme E2
Selama tahun 1920-an, Sir Christopher Ingold mengusulkan suatu model untuk menjelaskan sebuah tipe ganjil dalam reaksi kimia: mekanisme E2. E2 merupakan singkatan darieliminasi bimolekular. Reaksi tersebut melibatkan mekanisme satu-tahap di mana ikatan karbon-hidrogen dan karbon-halogen terputus untuk membentuk ikatan rangkap dua (ikatan pi C=C).
Karakteristik mekanisme reaksi ini diantaranya:
- E2 adalah eliminasi satu tahap, dengan satu keadaan transisi.
- Biasanya terjadi pada alkil halida primer tersubstitusi, namun mungkin terjadi pada alkil halida sekunder dan senyawa lainnya.
- Laju reaksinya mengikuti orde kedua, karena reaksi dipengaruhi baik oleh alkil halida dan basa (bimolekular).
- Karena mekanisme E2 menghasilkan pembentukan ikatan pi, dua gugus pergi (terkadang sebuah hidrogen dan suatu halogen) harus antiperiplanar. Keadaan transisi antiperiplanar memiliki konformasi goyang (staggered) dengan energi yang lebih rendah dibanding keadaan transisi sinperiplanar di mana konformasi eklips dengan energi yang lebih tinggi. Mekanisme reaksi yang melibatkan konformasi goyang lebih disukai pada reaksi E2 (tidak seperti reaksi E1).
- E2 biasanya menggunakan basa kuat. Basa harus cukup kuat untuk melepas hidrogen yang kurang asam.
- Agar ikatan pi dapat terbentuk, hibridisasi karbon harus lebih rendah dari sp3 menjadi sp2.
- Ikatan C-H dilemahkan dalam tahap penentu laju dan karenanya efek isotop deuterium primer lebih besar dari 1 (biasanya 2-6) teramati.
- E2 berkompetisi dengan mekanisme reaksi SN2 jika basa dapat bertindak pula sebagai nukleofil (pada banyak basa yang umum).

Contoh tipe reaksi ini dalam skema 1 adalah reaksi isobutilbromida dengan kalium etoksida dalam etanol. Produk reaksi tersebut adalah isobutilena, etanol dan kalium bromida.
Mekanisme E1
E1 adalah suatu model untuk menjelaskan jenis tertentu dari reaksi eliminasi kimia. E1 merupakan singkatan dari eliminasi unimolekular serta memiliki karakteristik berikut.
- Merupakan proses eliminasi dua-tahap: ionisasi dan deprotonasi.
- Ionisasi: ikatan karbon-halogen putus menghasilkan zat antara karbokation.
- Deprotonasi karbokation.
- E1 umumnya terjadi pada alkil halida tersier, namun mungkin terjadi pada beberapa alkil halida sekunder.
- Laju reaksi dipengaruhi hanya oleh konsentrasi alkil halida karena pembentukan karbokation adalah tahap paling lambat, alias tahap penentu laju. Karenanya, kinetika orde pertama berlaku (unimolekular).
- Reaksi biasanya terjadi pada ketiadaan basa atau hanya dalam kehadiran basa lemah (kondisi asam dan suhu tinggi).
- Reaksi E1 berkompetisi dengan mekanisme reaksi SN1 karena keduanya berbagi zat antara karbokationik yang umum.
- Efek isotop deuterium sekunder yang agak lebih besar dari 1 (biasanya 1 - 1.5) teramati.
- Tidak dibutuhkan antiperiplanar. Contohnya pada pirolisis pada suatu ester sulfonat tertentu pada mentol:

- Hanya produk reaksi A yang dihasilkan dari eliminasi antiperiplanar. Kehadiran produk B adalah indikasi bahwa mekanisme E1 terjadi.
Contoh dalam skema 2 merupakan reaksi tert-butilbromida dengan kalium etoksida dalam etanol.
Eliminasi E1 terjadi dengan alkil halida yang sangat tersubstitusi karena dua alasan.
- Alkil halida yang sangat tersubstitusi sangat meruah, membatasi ruang bagi mekanisme satu-tahap E2; karenanya, mekanisme dua-tahap E1 lebih disukai.
- Kabokation yang sangat tersubstitusi lebih stabil dibanding kation tersubstitusi metil atau primer. Kestabilan tersebut memberi waktu bagai mekanisme dua-tahap E1 terjadi.
- Jika jalur reaksi SN1 dan E1 berkompetisi, jalur E1 dapat lebih disukai dengan peningkatan panas.
Masalah :
Jika pada reaksi substitusi nukleofilik atom/ gugus yang diganti mempunyai keelektronegativan lebih kecil dari atom C,apakah reaksi tidak akan berlangsung?mengapa terjadi hal demikian?
Jika pada reaksi substitusi nukleofilik atom/ gugus yang diganti mempunyai keelektronegativan lebih kecil dari atom C,apakah reaksi tidak akan berlangsung?mengapa terjadi hal demikian?




Apakah eliminasi unimolekular itu?
BalasHapusApakah yang dimaksud dengan Deprotonasi karbokation?
BalasHapusKomentar ini telah dihapus oleh administrator blog.
BalasHapusTolong jelaskan Reaksi perubahan etanol menjadi etil klorida,
BalasHapusCoba jelaskan ciri reaksi SN2
BalasHapusDidalam reaksi substitusi terdapat substitusi elektrofilik, yg ingin saya tanyakan, mengapa boron bersifat elektrofilik?
BalasHapus